醫療器械生產監督檢查再次強化,重點監管品種已出爐。
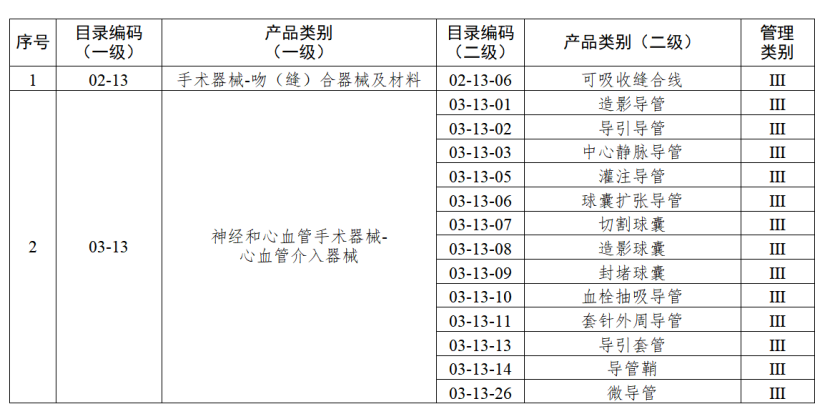
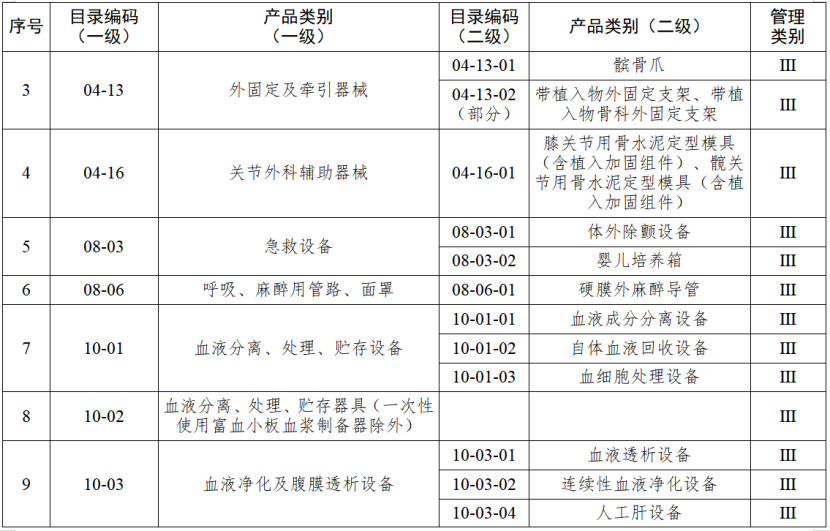
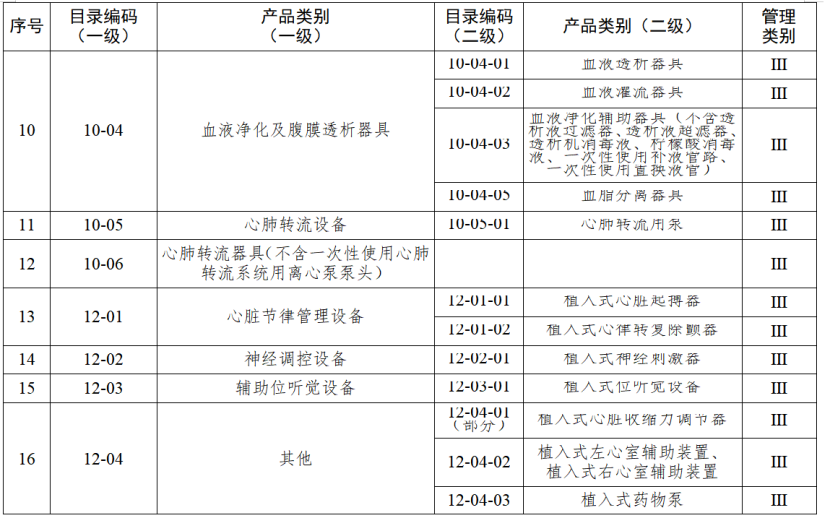
近期,江蘇省藥監局發布《江蘇省醫療器械生產分級監管實施辦法》(以下簡稱《辦法》),其中明確,4月7日起執行醫療器械生產分級監管。分級監管是指根據醫療器械的風險程度以及醫療器械注冊人備案人、受托生產企業的質量管理水平,結合醫療器械不良事件、企業監管信用及產品質量投訴狀況等因素,將醫療器械注冊人備案人、受托生產企業分為不同的級別,按照風險分級、科學監管,全面覆蓋、動態調整,落實責任、提升效能的原則,實施屬地化分級動態管理的活動。根據國家藥品監督管理局《醫療器械生產重點監管品種目錄》,結合江蘇省醫療器械生產企業實際,省局制定《江蘇省醫療器械生產重點監管品種目錄》(以下簡稱《目錄》)并進行動態調整。《辦法》明確,對醫療器械注冊人備案人、受托生產企業的監管分為四個級別。
對風險程度高的企業實施四級監管,主要包括生產省局《目錄》內四級監管醫療器械的企業,以及質量管理體系運行狀況差、有嚴重不良監管信用記錄的企業。
對風險程度較高的企業實施三級監管,主要包括生產省局《目錄》內三級監管醫療器械的企業,未列入四級監管的所有第三類醫療器械生產企業,以及質量管理體系運行狀況較差、有不良監管信用記錄的企業。
對風險程度一般的企業實施二級監管,主要包括生產省局《目錄》內二級監管醫療器械的企業,以及未列入省局《目錄》的所有第二類醫療器械生產企業。
對風險程度較低的企業實施一級監管,主要包括生產省局《目錄》外的所有第一類醫療器械生產企業。
同一醫療器械注冊人備案人、受托生產企業持有注冊證或受托生產的醫療器械產品類別涉及多個監管級別的,按照最高監管級別對該企業進行監管。此外,對于當年內醫療器械注冊人備案人、受托生產企業出現嚴重質量事故,或存在新增高風險產品、國家集中帶量采購中選產品、創新產品等情況的,應當即時評估并將監管級別上調一級。對于長期以來監管信用狀況較好的企業,藥品監督管理部門可以將監管級別下調一級。監管要求方面,《辦法》規定, 對實施四級監管的企業,負責日常監管的藥品監督管理部門每年至少組織一次全項目檢查。對實施三級監管的企業,負責日常監管的藥品監督管理部門每年至少組織一次檢查,其中每兩年全項目檢查不少于一次。
對實施二級監管的企業,負責日常監管的藥品監督管理部門每兩年檢查不少于一次。對實施一級監管的企業,負責日常監管的藥品監督管理部門每年隨機抽取本行政區域25%以上的企業進行監督檢查,并對新增第一類醫療器械生產企業在生產備案之日起3個月內開展現場檢查。今年1月起,國家藥監局綜合司《關于加強醫療器械生產經營分級監管工作的指導意見》正式執行。《指導意見》提出了對醫療器械生產經營企業的監管級別劃分原則和檢查要求,藥品監管部門可以按照風險將醫療器械企業劃分為四個監管級別,對不同監管級別的企業實施相應監管措施。對于長期以來監管信用狀況較好的企業,可以酌情下調監管級別;對于跨區域委托生產的醫療器械注冊人,僅進行受托生產的受托生產企業,以及異地增設庫房的經營企業等,應當酌情上調監管級別。醫療器械生產監管堅持問題導向,綜合運用監督檢查、重點檢查、跟蹤檢查、有因檢查和專項檢查等多種形式強化監督管理。監督檢查可以采取非預先告知的方式進行,重點檢查、有因檢查和專項檢查原則上采取非預先告知的方式進行。醫療器械經營監管檢查方式原則上應當采取突擊性監督檢查,鼓勵采用現代信息技術手段實施監督管理,提高監管效率和水平。醫療器械生產監管方面,國家藥監局根據醫療器械產品風險程度制定并動態調整醫療器械生產重點監管品種目錄;省、自治區、直轄市藥品監督管理部門綜合分析本行政區域同類產品注冊數量、市場占有率、生產質量管理總體水平和風險會商情況等因素,對國家藥品監督管理局制定的目錄進行補充,確定本行政區域醫療器械生產重點監管品種目錄并進行動態調整。截至目前,國家及部分省份醫療器械生產重點監管品種目錄已相繼出臺。分級監管之下,重點醫療器械的生產監管將進一步強化。
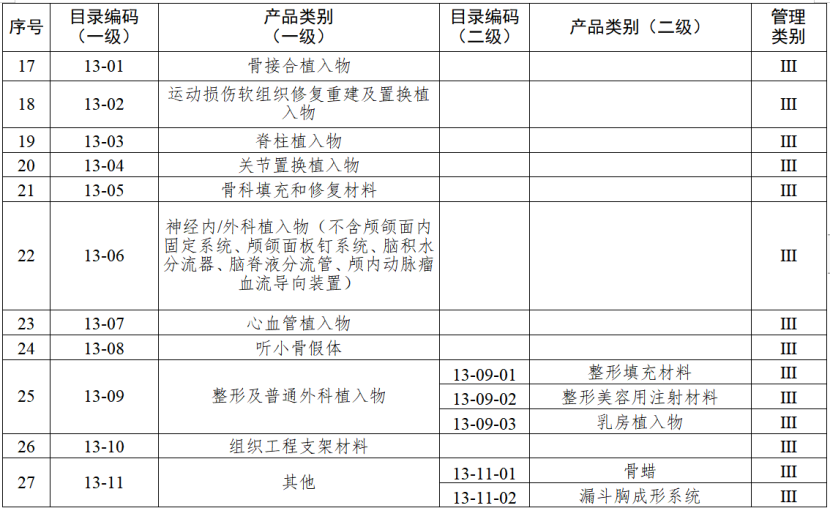
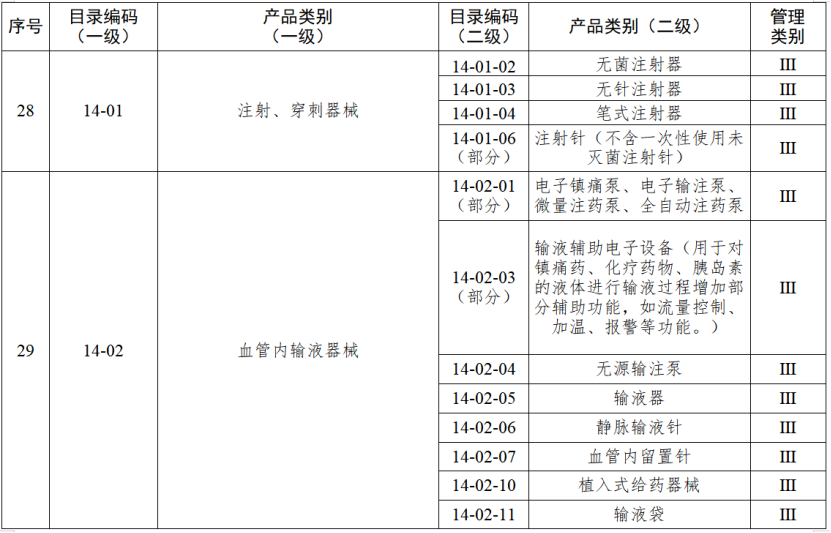
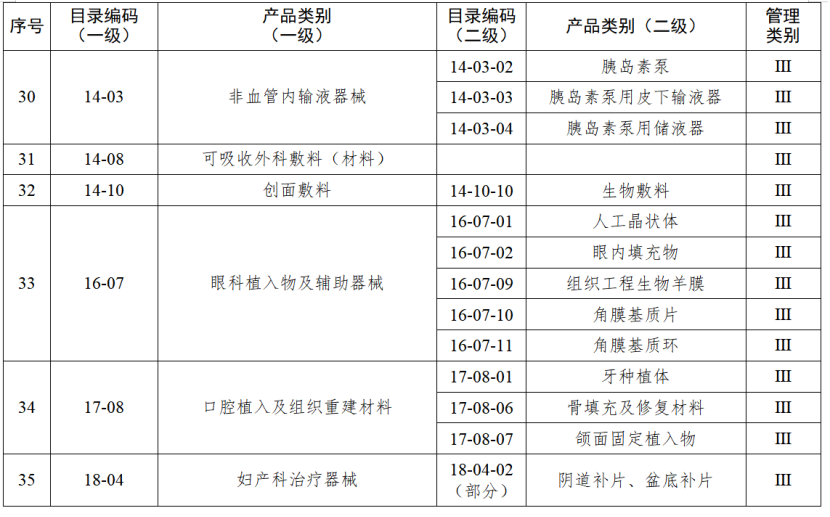
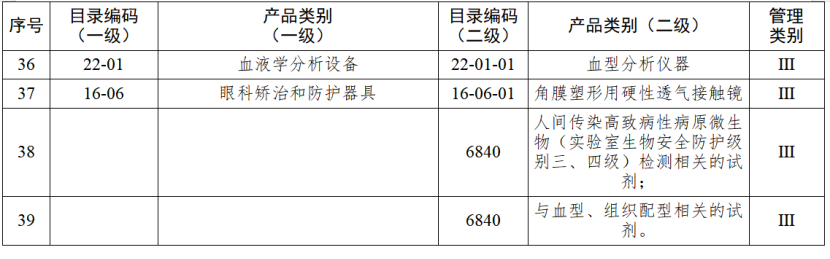
來源 | 賽柏藍器械
主站蜘蛛池模板:
获嘉县|
和政县|
民乐县|
双辽市|
九江县|
石屏县|
广元市|
荔波县|
延津县|
孟州市|
博白县|
尼玛县|
延川县|
宜川县|
仁寿县|
扬中市|
广平县|
罗源县|
肥乡县|
闻喜县|
浦北县|
驻马店市|
沙河市|
都安|
乌兰浩特市|
蒲城县|
仪征市|
永登县|
尼木县|
阳谷县|
泸州市|
北安市|
额尔古纳市|
龙井市|
商丘市|
甘泉县|
商洛市|
从江县|
珲春市|
阿拉善左旗|
修武县|